Legătură de hidrogen
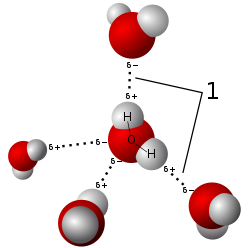
Legătura de hidrogen, cunoscută de asemenea și sub denumirea de punte de hidrogen reprezintă atracția electrostatică dintre moleculele polare, care are loc atunci când un atom de hidrogen care este legat de un atom cu o electronegativitate ridicată, cum ar fi azotul, oxigenul sau fluorul, prezintă atracție față de un alt atom electronegativ din apropiere.
Aceste punți de hidrogen pot apărea intermolecular, adică între molecule diferite, sau intramolecular, adică între componenții unei singure molecule. [1] Legătura de hidrogen este mai puternică decât interacția van der Waals, dar este mai slabă decât legăturile covalente sau ionice. Această legătură este prezentă atât în compușii anorganici, precum apa, cât și în compușii organici, cum sunt ADN-ul sau proteinele.
Referințe
- ^ IUPAC, Compendium of Chemical Terminology, Ed. a 2-a („Gold Book”) (1997). Versiune online: (2006-) „hydrogen bond”.
Bibliografie
- Ilie Bădilescu, Legătura de hidrogen, EȘE, 1981
Legături externe
- Legătura de hidrogen Arhivat în , la Wayback Machine.
| ||||||||||||||||||||||||||||||||||||









