Ester
| Acest articol are nevoie de ajutorul dumneavoastră. Puteți contribui la dezvoltarea și îmbunătățirea lui apăsând butonul Modificare. |
| Această pagină (secțiune) necesită o verificare. De verificat: veridicitatea informațiilor Ștergeți eticheta numai după rezolvarea problemelor. |
| Acest articol are nevoie de atenția unui expert în chimie. Recrutați unul sau, dacă sunteți în măsură, ajutați chiar dumneavoastră la îmbunătățirea articolului! |

Esterii sunt derivați funcționali ai acizilor carboxilici, care provin prin eliminarea unei molecule de H2O, formată din H-ul grupei -OH de la un alcool sau fenol și grupa -OH de la carboxilul unui acid.
Nomenclatură
Esterii se denumesc ca săruri ale acizilor corespunzători la care se adaugă numele radicalului adiționat din alcool sau fenol.
Clasificare
După natura radicalilor
Esteri alifatici
Se numesc esteri alifatici acei esteri, ai căror radicali sunt numai alifatici.
-
 Acetat de metil
Acetat de metil -
 Acetat de etil
Acetat de etil
Esteri aromatici
Se numesc esteri aromatici acei esteri, ai căror radicali sunt numai aromatici.

Esteri micști
Se numesc esteri micști acei esteri, ai căror radicali sunt și alifatici și aromatici.
-
 Benzoat de metil
Benzoat de metil -
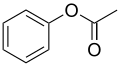 Acetat de fenil
Acetat de fenil
După numărul grupelor funcționale
Monoesteri
Toți esterii prezentați anterior sunt monoesteri.
Poliesteri
, oxalat de dimetil;
, tereftalat de dimetil; acolada reprezintă un nucleu benzenic;
Metode de obținere
În reacția dintre un alcool și un acid, rezultă ester și apă.
 , la 100 °C și în prezență de H2SO4;
, la 100 °C și în prezență de H2SO4;
Această reacție are echilibrul deplasat spre stânga, deoarece acidul reacționează greu cu alcoolul. Randamentul acestei reacții este nesatisfăcător, deoarece rămân netransformate la echilibru o treime din acid și o treime din alcool. Pentru a deplasa echilibrul reacției de esterificare la dreapta, se poate acționa în două moduri:
- creșterea concentrației unuia din reactanți;
- eliminarea unui produs pe măsură ce se formează.
O altă modalitate de a obține esteri este reacția dintre un alcool , alcoxid, fenol sau fenoxid cu anhidride acide sau cloruri acide.



 ]
]
 ]
]
Proprietăți fizice
Esterii sunt substanțe lichide, de obicei cu mirosuri plăcute. Sunt greu solubili în apă și solubili în solvenți organici.
Punctele lor de fierbere sunt scăzute, pentru că între moleculele de esteri nu se pot realiza legături de hidrogen, care sunt puternice.
Proprietăți chimice
Reacția de hidroliză
Catalizator acid (H2SO4)

Catalizator bazic (NaOH)
La această reacție hidroxidul de sodiu participă efectiv la reacție, ca reactant.

Reacția cu NH3
Această reacție se mai numește și amonoliza esterilor.

Utilizare
Esterii sunt folosiți în principal ca solvenți organici. De asemenea, ei sunt utilizați în industria alimentară drept esențe aromate.





























