Trifluoruro di tiofosforile
| Trifluoruro di tiofosforile | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Trifluoro(sulfanilidene)-λ5-fosfano | |
| Caratteristiche generali | |
| Formula bruta o molecolare | PSF3 |
| Aspetto | gas incolore |
| Numero CAS | 2404-52-6 |
| PubChem | 137585 |
| SMILES | FP(F)(F)=S |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,56 |
| Solubilità in acqua | reagisce |
| Temperatura di fusione | −148,8 °C (124 K)[1] |
| Temperatura di ebollizione | −52,2 °C (221 K)[1] |
| Indicazioni di sicurezza | |
| Modifica dati su Wikidata · Manuale | |
Il trifluoruro di tiofosforile è il composto inorganico con formula PSF3. In questo fluoruro il fosforo è formalmente nello stato di ossidazione +5. In condizioni normali è un gas incolore che si idrolizza al contatto con acqua e si infiamma spontaneamente all'aria.[1][2]
Sintesi
Il trifluoruro di tiofosforile fu sintetizzato per la prima volta da Thorpe e Rodger nel 1888 riscaldando pentasolfuro di fosforo e fluoruro di piombo in assenza di aria e umidità:[3][4]
Essi notarono che si otteneva PSF3 anche riscaldando P2S5 e BiF3, o da PbF2, zolfo e fosforo, oppure anche da AsF3 e PSCl3.
Successivamente sono stati descritti altri metodi per produrre il composto. Si può aggiungere fluoruro di sodio a PSCl3 in soluzione di acetonitrile.[5] Altrimenti il trifluoruro di fosforo può reagire con solfuro di idrogeno, purché a 200 ºC e 4000 atm:[6]
Si può anche far reagire sotto pressione PF3 e zolfo.[7]
Proprietà
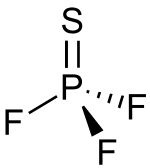
Il trifluoruro di tiofosforile è un composto molecolare polare. La forma della molecola è di tipo tetraedrico, con simmetria C3v.[1] La distanza P-S risulta 187±3 pm, quella P-F 153±2 pm e l'angolo F-P-F è 100,3°±2°.[8]
Reattività
La chimica del trifluoruro di tiofosforile fu caratterizzata già da Thorpe e Rodger nel 1889.[4] In condizioni normali il composto è un gas molto reattivo; sotto pressione condensa formando un liquido incolore. All'aria in presenza di umidità si infiamma spontaneamente con una fiamma di colore variabile dal blu al grigio-verde a seconda delle condizioni, mentre si producono fumi bianchi. Con ossigeno secco la combustione può non essere spontanea e la fiamma è di colore giallo. I prodotti finali sembrano essere PF5, P2O5 e SO2. Una particolarità di queste fiamme è la loro bassa temperatura. Thorpe e Rodger notarono:[4]
«È probabilmente una delle più fredde fiamme note. Le nostre mani ne sono state spesso circondate senza provocare sensazioni di calore troppo fastidiose.»
Si decompone per riscaldamento formando zolfo, fosforo e fluoruri di zolfo. Se riscaldato in un tubo di vetro il composto si decompone attaccando il vetro, con formazione di SiF4, secondo la reazione:
In acqua idrolizza rapidamente dando soluzioni acide, in accordo con la reazione:
In soluzione basica si scioglie più rapidamente che in acqua, dando luogo alla reazione
La reazione con ammoniaca gassosa porta alla formazione di fumi bianchi; i dati analitici sono in accordo con la reazione
Gli atomi di fluoro possono essere sostituiti per dare composti derivati come ad esempio PSF2Cl, PSFCl2, PSF2Br, PSFBr2, PSFClBr, PS(NCO)3 e PS(NCS)3. Sono noti anche composti condensati come P2S4F4.[1][2]
Note
Bibliografia
- (EN) G. Bettermann, W. Krause, G. Riess e T. Hofmann, Phosphorus Compounds, Inorganic, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a19_527.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (EN) A. P. Hagen e E. A. Elphingstone, High pressure interaction of phosphorus trifluoride with oxygen, sulfur, selenium, and tellurium, in Inorg. Chem., vol. 12, n. 2, 1973, pp. 478-480, DOI:10.1021/ic50120a050.
- (EN) A. P. Hagen e B. W. Callaway, High-pressure reactions of small covalent molecules. 10. The reaction of phosphorus trifluoride with hydrogen sulfide and sulfur dioxide, in Inorg. Chem., vol. 17, n. 3, 1978, pp. 554-555, DOI:10.1021/ic50181a007.
- (EN) D. K. Padma, S. K. Vijayalakshmi e A. R. Vasudevamurthy, Investigations on the preparation, oxidation and reduction reactions of thiophosphoryl fluoride, in Journal of Fluorine Chemistry, vol. 8, n. 6, 1976, pp. 461-465, DOI:10.1016/S0022-1139(00)81660-7.
- (EN) T. E. Thorpe e J. W. Rodger, LX.—Thiophosphoryl fluoride, in J. Chem. Soc., Trans., vol. 53, 1888, pp. 766-767, DOI:10.1039/CT8885300766.
- (EN) T. E. Thorpe e J. W. Rodger, XXXIV.—On thiophosphoryl fluoride, in J. Chem. Soc., Trans., vol. 55, 1889, pp. 306-323, DOI:10.1039/CT8895500306.
- (EN) Q. Williams, J. Sheridan e W. Gordy, Microwave Spectra and Molecular Structures of POF3, PSF3, POCl3, and PSCl3, in J. Chem. Phys., vol. 20, n. 1, 1952, pp. 164, DOI:10.1063/1.1700162.
Altri progetti
Altri progetti
- Wikimedia Commons
 Wikimedia Commons contiene immagini o altri file su Trifluoruro di tiofosforile
Wikimedia Commons contiene immagini o altri file su Trifluoruro di tiofosforile
 Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia
Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia
















