Natriumpersulfaat
| Natriumpersulfaat | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
 | |||||
Natriumpersulfaat | |||||
 | |||||
kristalrooster van natriumpersulfaat | |||||
| Algemeen | |||||
| Molecuulformule | |||||
| IUPAC-naam | Natriumpersulfaat | ||||
| Andere namen | Natriumperoxodisulfaat | ||||
| Molmassa | 238,10 g/mol | ||||
| SMILES | [Na+].[Na+].O=S(=O)([O-])OOS([O-])(=O)=O | ||||
| CAS-nummer | 7775-27-1 | ||||
| EG-nummer | 231-892-1 | ||||
| PubChem | 62655 | ||||
| Wikidata | Q419438 | ||||
| Beschrijving | Fijn, wit poeder | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H272 - H302 - H315 - H317 - H319 - H334 - H335 - H371 | ||||
| EUH-zinnen | P220 - P261 - P280 - P305+P351+P338 - P342+P311 | ||||
| VN-nummer | 1505 | ||||
| Fysische eigenschappen | |||||
| Dichtheid | [1]2,59 g/cm3 losse bulk: 1,12 g/cm³ | ||||
| Smeltpunt | (ontleed) 180 °C | ||||
| Oplosbaarheid in water | (20 °C) 556 g/L | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Natriumpersulfaat, soms ook natriumperoxydisulfaat genoemd, is de anorganische verbinding, een zout van natrium en peroxodizwavelzuur. De formule van het zout is . Het is een witte, vaste stof die goed oplosbaar is in water. De stof is vrijwel niet hygroscopisch. Bewaren gedurende lange tijd is nauwelijks een probleem.
Synthese
Het zout wordt bereid via elektrolytische oxidatie van natriumwaterstofsulfaat:
De oxidatie vindt plaats aan een platina-elektrode.[2] Op deze manier wordt jaarlijks (2005) ongeveer 165.000 ton van het zout geproduceerd.[3]
Deze productiemethode heeft een aantal nadelen. De eerste daarvan is de hoge standaard elektrode potentiaal van persulfaat. In onderstaande tabel zijn een aantal relevante waarden bij elkaar geplaatst
De reacties aan de platina anode verlopen van rechts naar links. Normaal gesproken zal de sterkste reductor, hier water, reageren. De noodzakelijke overspanning voor deze reactie (en de andere sterkere reductoren dan sulfaat) zorgt ervoor dat de gewenste reactie toch kan optreden. Helemaal te voorkomen zijn de nevenreacties echter niet en een aanzienlijk deel van het rendementsverlies komt voor rekening van het toch gevormde zuurstofgas.
Een ander deel van de verliezen komt voor rekening van de hoge redoxpotentiaal van het initieel gevormde , een radicaal-anion. Combinatie met een ander radicaal-anion leidt tot het gewenste persulfaat. Deze zeer sterke oxidator zal echter ook snel met elke reductor kunnen reageren (zie hieronder).
De hierboven al genoemde hoge redox-potentiaal van het -ion leidt ook tot aantasting van de platina-elekrode. De oxidatieproducten van de elektrode komen vervolgens als verontreiniging in het gevormde persulfaat terecht. Om deze reden zijn met boor gedopede diamanten elektrodes voor deze reactie voorgesteld.[6]
Toepassingen
Natriumpersulfaat wordt voornamelijk toegepast als initiator voor polymerisatie-reacties voor emulsies. Deze laatste vinden veel toepassing in de analyses in PCR-testen.[3]
Andere toepassingen
Natriumpersulfaat kan gebruikt worden als bleekmiddel, zowel als enkelvoudig reagens (met name in de kappersbranche) als in combinatie met zeep. Het wordt toegepast als vervanging van ammoniumpersulfaat in mengsels voor het etsen van zink en printplaten. wordt het ook soms toegepast.
In de landbouw wordt het gebruikt als bodemverbeteraar en bij de schoonmaak van bodem- en waterverontreiniging wordt het als reagens gebruikt.[6][7]
Industrieel vindt het toepassing bij de productie van kleurstoffen, gemodificeerd zetmeel, als schoonmaakmiddel voor het oppervlak van koper en sommige andere metalen, bleekcomponent in wasmiddelen, etc.
Organische chemie
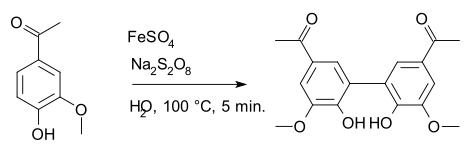
Natriumpersulfaat is een selectieve oxidator in de organische chemie, met name de Boyland-Sims-oxidatie en de Elbs-persulfaatoxidatie. Het wordt toegepast in radicaalreacties, zoals de synthese van diapocynine uit apocynine waarin ijzer(II)sulfaat het uiteindelijke werkzame radicaal is:[8]
Veiligheid
Het zout is een sterke oxidator en vormt ontbrandbare mengsels met bijvoorbeeld papier. Mengsel met sterke reductoren als magnesium kunnen zelfs explosief zijn.
Zie ook
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Composition B op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ FMC Corporation. Sodium Persulfate. Archived copy. Gearchiveerd op 21 november 2011. Geraadpleegd op 17 november 2013. (accessed Nov 17, 2013).
- ↑ Pietzsch, A.; Adolph, G. J. Chem. Technol. Biotechnol. 1911, 30, 85.
- ↑ a b Peroxo Compounds, Inorganic, Harald Jakob, Stefan Leininger, Thomas Lehmann, Sylvia Jacobi, Sven Gutewort, DOI:10.1002/14356007.a19_177.pub2
- ↑ Block, Philip A., Richard A. Brown, and David Robinson. "Novel activation technologies for sodium persulfate in-situ chemical oxidation." Proceedings of the Fourth International Conference on the remediation of chlorinated and recalcitrant compounds. 2004.
- ↑ Tabel van standaardelektrodepotentialen
- ↑ a b Shafiee, Saiful Arifin, Aarons, Jolyon, Hairul Hisham, Hamzah (2018). Electroreduction of Peroxodisulfate: A Review of a Complicated Reaction. Journal of the Electrochemical Society 165 (13): H785–H798 (ECS). DOI: 10.1149/2.1161811jes.
- ↑ Wacławek, S., Lutze, H. V., Grübel, K., Padil, V.V.T., Černík, M., Dionysiou, D.D. (2017) (2017). Chemistry of persulfates in water and wastewater treatment: A review.. Chemical Engineering Journal 330: 44–62. DOI: 10.1016/j.cej.2017.07.132.
- ↑ Luchtefeld, Ron, Dasari, Mina S., Richards, Kristy M., Alt, Mikaela L., Crawford, Clark F. P. (2008). Synthesis of Diapocynin. J. Chem. Educ. 85 (3): 411. DOI: 10.1021/ed085p411.