Magnesium oksida
 | |
 | |
| Nama | |
|---|---|
| Nama IUPAC Magnesium oksida Magnesium oxide | |
| Nama lain Magnesia Periklas | |
| Pengecam | |
No. Pendaftaran CAS |
|
Imej model 3D Jmol |
|
| ChEMBL |
|
| ECHA InfoCard | 100.013.793 |
| Nombor EC |
|
| Nombor E | E530 (pengawal keasidan pH & agen antikerakan) |
PubChem CID |
|
| Nombor RTECS |
|
CompTox Dashboard (EPA) |
|
SMILES
| |
| Sifat | |
Formula kimia | MgO |
| Jisim molar | 40.304 g/mol[1] |
| Rupa bentuk | Serbuk putih |
| Bau | Tiada bau |
| Ketumpatan | 3.6 g/cm3[1] |
| Takat lebur | 2,852 °C (5,166 °F; 3,125 K)[1] |
| Takat didih | 3,600 °C (6,510 °F; 3,870 K)[1] |
| Keterlarutan | Larut dalam asid, ammonia Tidak larut dalam alkohol |
| Luang jalur | 7.8 eV[2] |
Kerentanan magnet (χ) | −10.2·10−6 cm3/mol[3] |
| Kekonduksian haba | 45–60 W·m−1·K−1[4] |
Indeks biasan (nD) | 1.7355 |
| Momen dwikutub | 6.2 ± 0.6 D |
| Struktur | |
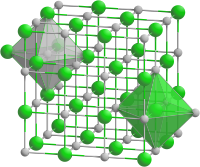
| Struktur kristal | Halit (kubik), cF8 |
| Kumpulan ruang | Fm3m, No. 225 |
| Pemalar kekisi | a = 4.212Å |
| Geometri koordinasi | Oktahedron (Mg2+ dan O2−) |
| Termokimia | |
| Muatan haba tentu, C | 37.2 J/mol K[5] |
| Entropi molar piawai S | 26.95 ± 0.15 J·mol−1·K−1[6] |
Entalpi pembentukan piawai (ΔfH⦵298) | −601.6 ± 0.3 kJ·mol−1[6] |
Tenaga bebas Gibbs (ΔfG˚) | -569.3 kJ/mol[5] |
| Farmakologi | |
| Kod ATC | A02AA02 A06AD02, A12CC10 |
| Bahaya | |
| Bahaya-bahaya utama | Merengsa |
| MSDS | ICSC 0504 |
| Frasa R | Templat:R36, Templat:R37, Templat:R38 |
| NFPA 704 (berlian api) |  0 1 0 |
| Takat kilat | Tidak mudah terbakar |
| NIOSH (Had pendedahan kesihatan AS): | |
PEL (Dibenarkan) | TWA 15 mg/m3 (wasap)[7] |
REL (Disyorkan) | TIAda[7] |
IDLH (Bahaya serta-merta) | 750 mg/m3 (wasap)[7] |
| Sebatian berkaitan | |
Anion lain | Magnesium sulfida |
Kation lain | Berilium oksida Kalsium oksida Strontium oksida Barium oksida |
Sebatian berkaitan | Magnesium hidroksida Magnesium nitrida |
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |
 Y pengesahan (apa yang perlu: Y pengesahan (apa yang perlu:  Y/ Y/ N?) N?) | |
| Rujukan kotak info | |
Mangnesium oksida atau magnesia ialah sebatian kimia magnesium dengan formula kimia MgO. Sebatian ini merupakan pepejal serbuk putih hidroskopik dan terdiri daripada ion-ion Mg2+ dan O2− yang terikat dalam ikatan ionik.
Penghasilan
Magnesium oksida dapat dihasilkan melalui pengkalsinatan magnesium hidroksida dan magnesium karbonat. Magnesium hidroksida boleh didapati daripada larutan magnesium klorida, biasanya air laut dengan kapur.[8]
Penggunaan
Magnesium oksida banyak digunakan sebagai bahan refraktori, di mana sebatian ini bersifat stabil dalam suhu tinggi dan biasanya digunakan untuk membuat mangkuk pijar. Magnesium oksida diambil sebagai antasid serta sebagai laksatif jangka pendek. Sebatian ini juga boleh mengurangkan simptom ketakcernaan.
Dalam bidang pemakanan, magnesium oksida digunakan sebagai agen antikempal dengan nombor E E530. Sebatian ini juga banyak digunakan sebagai baja tumbuhan dan makanan haiwan.[9][10]
Rujukan
- ^ a b c d Haynes, William M., penyunting (2011). CRC Handbook of Chemistry and Physics (ed. 92). Boca Raton, FL: CRC Press. m/s. 4.74. ISBN 1439855110.
- ^ Taurian, O.E.; Springborg, M.; Christensen, N.E. (1985). "Self-consistent electronic structures of MgO and SrO" (PDF). Solid State Communications. 55 (4): 351–5. Bibcode:1985SSCom..55..351T. doi:10.1016/0038-1098(85)90622-2. Diarkibkan daripada yang asal (PDF) pada 2016-03-03. Dicapai pada 2019-07-11.
- ^ Haynes, William M., penyunting (2011). CRC Handbook of Chemistry and Physics (ed. 92). Boca Raton, FL: CRC Press. m/s. 4.133. ISBN 1439855110.
- ^ Application of magnesium compounds to insulating heat-conductive fillers Diarkibkan 2013-12-30 di Wayback Machine. konoshima.co.jp
- ^ a b Haynes, William M., penyunting (2011). CRC Handbook of Chemistry and Physics (ed. 92). Boca Raton, FL: CRC Press. m/s. 5.15. ISBN 1439855110.
- ^ a b Haynes, William M., penyunting (2011). CRC Handbook of Chemistry and Physics (ed. 92). Boca Raton, FL: CRC Press. m/s. 5.2. ISBN 1439855110.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. "#0374" (dalam bahasa Inggeris). National Institute for Occupational Safety and Health (NIOSH).
- ^ Margarete Seeger; Walter Otto; Wilhelm Flick; Friedrich Bickelhaupt; Otto S. Akkerman (2005), "Magnesium Compounds", Ullmann's Encyclopedia of Industrial Chemistry (dalam bahasa Inggeris), Weinheim: Wiley-VCH, doi:10.1002/14356007.a15_595.pub2
- ^ Nutrient Science. fertilizer101.org. Retrieved on 2017-04-26.
- ^ Magnesium oxide for the Animal Feed Industry. lehvoss.de








