三フッ化アンチモン
| 三フッ化アンチモン Antimony trifluoride | |
|---|---|
 |  |
 | |
antimony(III) fluoride | |
別称 フッ化アンチモン(III) | |
| 識別情報 | |
| CAS登録番号 | 7783-56-4 |
| PubChem | 24554 |
| ChemSpider | 22960? |
| EC番号 | 232-009-2 |
| 国連/北米番号 | UN 2923 |
| RTECS番号 | CC5150000 |
| |
| |
| 特性 | |
| 化学式 | SbF3 |
| モル質量 | 178.75 g/mol |
| 外観 | 無色の結晶 |
| 密度 | 4.379 g/cm3 |
| 融点 | 292℃ (565.15 K) |
| 沸点 | 376℃ (649.15 K) |
| 水への溶解度 | 可溶 |
| 構造 | |
| 結晶構造 | 斜方晶系, oS16 |
| 空間群 | Ama2, No. 40 |
| 関連する物質 | |
| 関連物質 | 五フッ化アンチモン |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
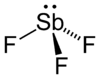
三フッ化アンチモン(さんフッかアンチモン、英: Antimony trifluorideはアンチモンのフッ化物で、化学式SbF3で表される無機化合物。
合成
無色ないし淡い灰色の結晶で、三酸化アンチモンとフッ化水素との直接反応により生成される[1][2]。
性質
二フッ化アンチモンの陽イオンと四フッ化アンチモンの陰イオンとに解離する。
固体の状態では配位数は6となる。
用途
有機化学の試薬[3]やフッ素化剤のほか、染色における媒染や機能性セラミックスの製造に用いられる。 1892年に、ベルギーの化学者フレデリック ジャン エドモント スワルト(Frédéric Jean Edmond Swarts)が初めてフッ素化試薬として用いたことから、「スワルト試薬」とも呼ばれている。
安全性
日本の毒物及び劇物取締法では劇物に該当する。発癌性及び高い腐食性があり、皮膚や目に激しい損傷を及ぼす。マウスに経口投与した場合の半数致死量(LD50)は804mg/kg[4]。
脚注
- ^ グリーンウッド, ノーマン; アーンショウ, アラン (1997). Chemistry of the Elements (英語) (2nd ed.). バターワース=ハイネマン(英語版). ISBN 978-0-08-037941-8。
- ^ Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (6th ed.), New York: Wiley-Interscience, ISBN 0-471-19957-5
- ^ Kirk‑Othmer Encyclopedia of Chemical Technology Fluorine Compounds, Inorganic, Antimony Tariq Mahmood and Charles B. Lindahl doi:10.1002/0471238961.0114200913010813.a01
- ^ 安全衛生情報センター
| |||
|---|---|---|---|
| Sb(III) |
| ||
| Sb(III,V) |
| ||
| Sb(V) |
| ||
| |||
- 表示
- 編集






