Joule-Kreisprozess
Der Joule-Kreisprozess oder Brayton-Kreisprozess ist ein thermodynamischer Kreisprozess, der nach James Prescott Joule beziehungsweise George Brayton benannt ist. Der rechtslaufende Prozess ist ein Vergleichsprozess für den in Gasturbinen und Strahltriebwerken ablaufenden Vorgang und besteht aus zwei isentropen und zwei isobaren Zustandsänderungen. Als linkslaufender Prozess eignet er sich auch für Wärmepumpen oder Kälteanlagen.
Beschreibung
- Prinzipskizze und Zustandsdiagramme
-
 Mechanische Umsetzung des geschlossenen Joule-Prozess
Mechanische Umsetzung des geschlossenen Joule-Prozess -
 Joule-Prozess im p-v-Diagramm
Joule-Prozess im p-v-Diagramm -
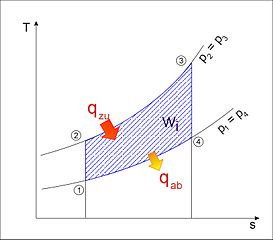 Joule-Prozess im T-s-Diagramm
Joule-Prozess im T-s-Diagramm
Die vier Prozessschritte sind im Einzelnen:
- 1 – 2 isentrope Kompression (dp>0, dQ=0, dv<0),
- Durch adiabaten Verdichter
- Zufuhr der Verdichterarbeit
- Druck steigt von auf
- Temperatur steigt von auf
- Spezifisches Volumen sinkt von auf
- Spezifische Entropie bleibt konstant
- 2 – 3 isobare Wärmezufuhr (dp=0, dQ>0, dv>0),
- Durch Wärmetauscher (Brennkammer)
- Zufuhr der spezifischen Wärme
- Druck bleibt konstant
- Temperatur steigt von auf
- Spezifisches Volumen steigt von auf
- Spezifische Entropie steigt von auf
- 3 – 4 isentrope Expansion (dp<0, dQ=0, dv>0),
- Durch adiabate Turbine
- Entzug der Turbinenarbeit
- Druck sinkt von auf
- Temperatur sinkt von auf
- Spezifisches Volumen steigt von auf Fehler beim Parsen (SVG (MathML kann über ein Browser-Plugin aktiviert werden): Ungültige Antwort („Math extension cannot connect to Restbase.“) von Server „http://localhost:6011/de.wikipedia.org/v1/“:): {\displaystyle v_4}
- Spezifische Entropie bleibt konstant
- 4 – 1 isobare Wärmeabfuhr (dp=0, dQ<0, dv<0).
- Durch Wärmetauscher (Kühler)
- Entzug der spezifischen Wärme
- Druck bleibt konstant
- Temperatur sinkt von auf
- Spezifisches Volumen sinkt von auf
- Spezifische Entropie sinkt von auf
Graphisch im T-s-Diagramm dargestellt ist die zugeführte Wärme die von der Isobaren zwischen 2 und 3 und der x-Achse eingeschlossenen Fläche. Die abgeführte Wärme entspricht der Fläche zwischen der Isobaren von 4 nach 1 und ebenfalls der x-Achse.[1]
Die vom Linienzug (1 – 2 – 3 – 4) umschlossene Fläche entspricht der spezifischen Prozessarbeit w (w = - ).
Im Gegensatz zum geschlossenen Joule-Prozess entfällt im offenen die Kühlung, da kontinuierlich kaltes Gas angesaugt und verdichtet wird.
Die Wärmezufuhr, die hier nur schematisch dargestellt ist, wird tatsächlich durch die Verbrennung eines meist fossilen Energieträgers realisiert. In Strahltriebwerken wird hierzu in der Regel Kerosin verwendet, das bei der Erdöldestillation eine Zwischenfraktion von Benzin und Diesel darstellt.
Die folgenden Bilder zeigen maßstäbliche Diagramme und eine Tabelle mit den Zustandsgrößen und Prozessdaten aus einer rechenaktiven Datei.
- Zustandsdiagramme und Datentabelle
-
 p-v-Diagramm
p-v-Diagramm -
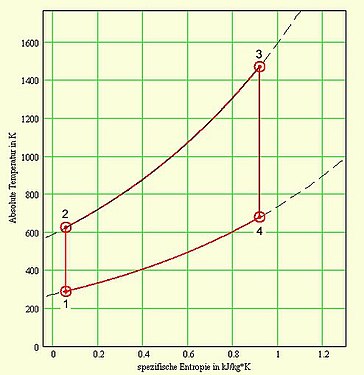 T-s-Diagramm
T-s-Diagramm -
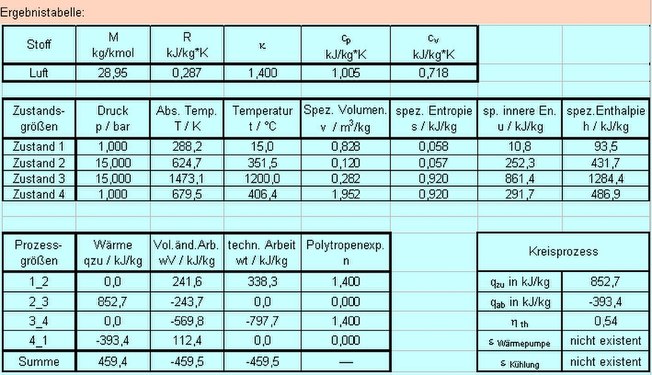 Datentabelle
Datentabelle
Wirkungsgrad
Wirkungsgrad im einstufigen Joule-Kreisprozess
Allgemein ist der thermische Wirkungsgrad definiert als das Verhältnis von Nutzen zu Aufwand.
Beim Joule-Prozess besteht der Nutzen in der abgegebenen technischen Arbeit wNutz, der Aufwand besteht in der benötigten Wärme qzu, so dass sich formulieren lässt:
Die bilanzierten Wärmen ersetzt man durch die Enthalpie-Differenzen. Verlaufen die zwei Isobaren entlang eines „zwei Phasen“-Gebiets, kann auch die mit dem System und der Umwelt ausgetauschte Wärmemenge mit der Differenz der Entropie mal der absoluten Temperatur verwendet werden. Damit ergibt sich dh=ds und der Prozess läuft mit dem Carnot-Wirkungsgrad.
Für ein ideales Gas gilt zudem, dass die spezifische Enthalpie h nur eine Funktion der Temperatur und unabhängig vom Druck ist.
deshalb ist
Die letzte Beziehung ergibt sich aus der Verwendung der Gleichung für die Temperaturänderung bei isentroper Kompression.

Der Isentropenexponent beträgt unter Normalbedingungen für Edelgase wie Helium und Argon ca. 1,66; für 2-atomige Gase wie Wasserstoff, Sauerstoff, Luft ca. 1,4 und für 3-atomige Gase mit starren Molekülen wie Wasserdampf ca. 1,33. Kreisprozesse können am effektivsten mit Edelgasen betrieben werden. Wenn allerdings die Wärmekapazität, die Wärmeleitfähigkeit, die Wärmeübergangszahl und die Viskosität mit beachtet werden, dann ist Wasserstoff ebenfalls ein sehr vorteilhaftes Arbeitsmedium.
Für eine durch den Werkstoff vorgegebene maximale Temperatur T3 lässt sich eine optimale Temperatur T2 nach der Kompression ermitteln, bei der der Kreisprozess die größtmögliche Nutzarbeit abwirft:
Möglichkeit der Erhöhung des Wirkungsgrads durch rekuperative Wärmeübertragung und durch einen mehrstufigen Joule-Kreisprozess
Da am Ausgang der Expansionsmaschine meistens eine Temperatur herrscht, die oberhalb der Temperatur am Ausgang des Kompressors liegt, kann über einen Wärmetauscher hier eine rekuperative Wärmeübertragung stattfinden. Diese Wärmemenge muss dann nicht von außen zugeführt werden. Zudem kann die zu überbrückende Temperaturdifferenz zwischen Erhitzer und Kühler vergrößert werden.
Der Wirkungsgrad berechnet sich dann wie folgt:
Durch eine mehrstufige Verdichtung mit jeweils nachgeschalteter Wärmeabfuhr kann die Verdichtungsarbeit vermindert werden, genauso kann durch mehrstufige Expansion mit jeweiliger Wärmezufuhr die Entspannungsarbeit vergrößert werden, wodurch der Wirkungsgrad des Gesamtprozesses steigt. Bei unendlich vielen Stufen der Kompression - Wärmeabfuhr geht der Prozess in eine isotherme Verdichtung über. Der Prozess wird dann durch den Ackeret-Keller oder Ericsson-Kreisprozess beschrieben, dessen Wirkungsgrad sich analog zum Carnot-Prozess berechnet:
Wartungsarme Wärmekraftmaschinen nach dem Joule-Kreisprozess
Wie eine Stirlingwärmekraftmaschine kann eine Wärmekraftmaschine nach dem Joule-Kreisprozess mit einer externen Wärmezufuhr betrieben werden und hat damit viele gemeinsame Vorteile mit einem Stirlingmotor.
Für die Kerntechnik (Atomkraftwerke) wurden Turbokompressoren für Helium entwickelt, die mit magnetischen Lagern und permanentmagnetischen Notlauflagern ausgestattet werden können, wodurch in das Arbeitsgas keine Flüssigkeiten wie Schmieröle eingebracht werden müssen, die den Gaskreislauf verunreinigen können.
Damit ist eine Gasturbine denkbar, die nach Joule-Kreisprozess als Vergleichsprozess mit Helium oder Wasserstoff als Arbeitsgas arbeitet, die wartungsarm, effizient und eine hohe Energiedichte aufweisen könnte.
Der reale Gasturbinenprozess

Der reale Gasturbinenprozess unterscheidet sich durch die Irreversibilität der technischen Zustandsänderungen (1-2, 3-4) vom theoretischen Joule-Prozess. Darüber hinaus treten Druckverluste in der Brennkammer (2-3) (bzw. dem Wärmeübertrager 4-1 im geschlossenen Gasturbinenprozess) auf. Die Druckänderung durch die Wärmeverluste in der Brennkammer können heutzutage durch geeignete Maßnahmen (hochtemperaturfeste Keramik) minimiert werden, während der Druckverlust im Wärmeübertrager (4-1) nur bedingt reduzierbar ist. Die genannten Unterschiede sind anschaulich im T-s-Diagramm darstellbar (T-Temperatur, s-spezifische Entropie).
Die technischen Arbeiten für den Verdichter und die Turbine werden im h,s-Diagramm veranschaulicht (h-spezifische Enthalpie, s-spezifische Entropie).
Andere Vergleichsprozesse
Weblinks
Einzelnachweise
- ↑ Thermodynamik 2. Abgerufen am 12. Juli 2017.
















































